Ausbremsen und antreiben
Mit biochemischen Werkzeugen erforscht Maja Köhn, wie sich bestimmte Enzyme verhalten, wenn das Immunsystem auf Eindringlinge trifft
Vernetzt, verzweigt, verbunden: Die Forscher untersuchen, wie Billionen von Zellen miteinander kommunizieren. Quelle: CIBSS/Universität Freiburg

Um biochemische Werkzeuge herzustellen, greift Maja Köhn auf ihre doppelte Ausbildung zurück – sie ist Chemikerin und Biologin. Foto: Jürgen Gocke
„Wir sind Werkzeugmacher“, erklärt Maja Köhn. Die Werkzeuge, die sie im Exzellenzcluster CIBSS herstellt, sind kleine Moleküle. Diese können, richtig eingesetzt, Enzyme und andere Proteine hemmen oder stimulieren – ausbremsen oder antreiben. Einige CIBSS-Wissenschaftlerinnen und -Wissenschaftler werden mit Köhns Werkzeugen arbeiten. Sie selbst interessiert sich für eine bestimmte Gruppe von Enzymen, die Phosphatasen. „Die sind faszinierend“, sagt die Molekularbiologin vom Institut für Biologie III der Universität Freiburg. Ihre Arbeitsgruppe erforscht, welche Rolle die Phosphatasen in Signalwegen spielen – unter anderem wenn das Immunsystem auf Eindringlinge oder Krebszellen reagiert.
Aufwind für die Stiefkinder der Wissenschaft
Phosphatasen waren zuletzt Stiefkinder der Wissenschaft. „Die Forschung hat sie weitgehend fallen lassen“, sagt Köhn. Es schien, als brächte es wenig, Phosphatasen zu untersuchen – anders als bei den Kinasen, ihren Gegenspielern. Kinasen hängen Phosphatgruppen an andere Proteine an. Phosphatasen spalten diese Phosphate wieder ab. Das Gleichgewicht zwischen den zwei Gegenspielern ist ein wichtiges Steuerelement in vielen Signalwegen. Es garantiert beispielsweise, dass Gewebe und Organe im menschlichen Körper korrekt heranwachsen, Verletzungen heilen und das Immunsystem schädliche Bakterien und Viren abwehrt. Entsprechend kann ein Ungleichgewicht zwischen Kinasen und Phosphatasen ernste Folgen haben, etwa Entwicklungsstörungen, Immunschwäche oder Krebs.
|
„Bei den Kinasen gelang Forschenden in den 1990er Jahren der Durchbruch“, erzählt Köhn. Wissenschaftler entdeckten Stoffe, die spezifisch nur wenige Kinasen – unter den vielen im Körper – hemmen. Damit waren neue Mittel für eine Reihe an Erkrankungen gefunden. Heute setzt die Medizin die Hemmstoffe etwa bei Lungenkrebs, Brustkrebs, Melanomen oder Magen-Darm-Tumoren ein, ebenso bei Autoimmunerkrankungen wie Rheumatoider Arthritis. Hier lösen Kinase-Hemmer im Vergleich zu herkömmlichen Medikamenten weniger Nebenwirkungen aus, weil sie so spezifisch arbeiten. „Es gibt über 30 Inhibitoren für Kinasen, aber fast keine für Phosphatasen“, sagt Köhn. Der Grund: Die Phosphatase-Hemmer, die Wissenschaftler in den 1990ern testeten, waren zu unspezifisch. Sie verursachten sehr viele Nebenwirkungen. Die Mehrheit der Fachwelt wandte sich von diesen Enzymen ab.
Krebs hindert Immunzellen daran, ihn zu bekämpfen
„Heute haben wir neue Methoden und neue Ansätze für die Forschung“, sagt Köhn. „Bei Phosphatasen ergibt sich dadurch viel Potenzial, das wir ausreizen können.“ Sie nennt ein Beispiel, mit dem sie sich schon beschäftigt hat – die Phosphatase PRL-3: „In gesundem Epithelgewebe, etwa im Darm, kommt die gar nicht vor.“ Anders sieht es aus, wenn dieses Gewebe entartet ist, also von Krebs befallen. „Je weiter der Krebs oder die Metastasen fortgeschritten sind, desto mehr PRL-3 finden wir. Die Phosphatase zerstört die Ordnung im Epithelgewebe.“ Unordnung bedeutet chaotisches, unkontrolliertes Wachstum und damit in der Regel Krebs. Köhn und ihre Gruppe haben die Biochemie von PRL-3 weitgehend aufgeklärt und einen Hemmstoff für die Phosphatase entwickelt. „Unter seiner Einwirkung ordnet sich das Gewebe wieder“, sagt die Wissenschaftlerin.
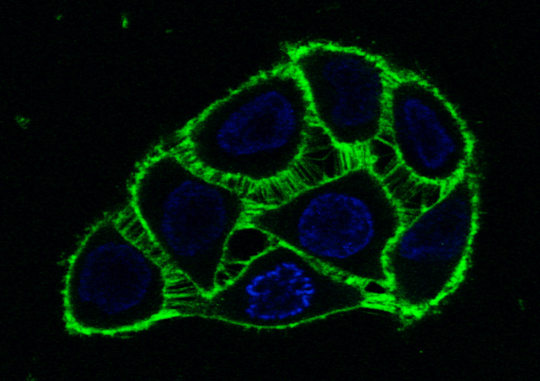
Das Peptid (grün), das die Phosphatase aktiviert, ist an der Membran in lebenden Zellen zu sehen.
Quelle: Jeremy Chojnacki
Nun hat Köhn vor, ein anderes wenig erforschtes Terrain zu erkunden: „Wir wollen die Phosphatasen in den Rezeptor-Signalwegen der Immunologie verstehen.“ Erneut bringt die Molekularbiologin ein Beispiel: Tumorzellen können außen auf ihrer Oberfläche ein Molekül exprimieren – also ein gebundenes Signalprotein präsentieren. An das binden T-Zellen, bestimmte Immunzellen. In ihnen springt daraufhin ein Signalweg an, der verhindert, dass die T-Zellen den Krebs bekämpfen. „Phosphatasen spielen hier eine große Rolle. Diesen Signalweg wollen wir bis ins Detail verstehen und herausfinden, was genau Phosphatasen darin machen.“ Um das zu erreichen, baut sie neue molekulare Werkzeuge. Mit geeigneten Hemmstoffen könnte Köhn den Signalweg räumlich und zeitlich sehr fein steuern. Sie hätte Einfluss darauf, an welchen Stellen der Signalkette gerade eine bestimmte Phosphatase oder mehrere Phosphatasen aktiv sind und auf die Stärke von deren Aktivität.
Perfekte Bindungen sollen zu Therapien führen
„Wir kennen die Strukturen der Enzyme ziemlich genau und wissen, wie sie dreidimensional aussehen“, erklärt Köhn. „Dadurch wissen wir auch über ihre Eigenschaften Bescheid.“ Am Computermodell kann sie sich anschauen, wie eine Phosphatase ihren natürlichen Partner bindet, das Protein, von dem sie ein Phosphat abspaltet. „Manchmal gibt es Lücken in der Bindung, also Schwachstellen“, so Köhn. Dann können die Mitglieder ihres Teams, die synthetische Chemie betreiben, Moleküle anfertigen, die besser passen und fester binden. Tests im Reagenzglas und in Zellkulturen zeigen anschließend: Bindet das Molekül kräftig genug? Kann es die Bindestelle an der Phosphatase prinzipiell blockieren und so das Enzym hemmen?

Golden und glasklar: Mit aufbereiteten Substanzen stellen Forschende Peptide her.
Foto: Jürgen Gocke
Alternativ kann die Arbeitsgruppe Mutationsstudien anstellen. Sie erzeugt viele Varianten von einem Phosphatasen-Bindepartner und testet jeweils, wie stark die einzelnen binden. „Danach schneiden wir die Bindestelle des besten Bindepartners heraus und bauen damit ein neues Molekül“, erzählt Köhn. Klappt das plangemäß, lässt sich die Bindestelle blockieren und die entsprechende Phosphatase hemmen. „Langfristig wünsche ich mir schon, dass eines unserer Moleküle einmal den Anstoß für einen neuen Wirkstoff gibt.“ Warum sollte schließlich bei Phosphatasen unmöglich sein, was bei Kinasen schon heute funktioniert? Innerhalb des Exzellenzclusters sind zumindest im Tiermodell Tests mit einigen der Moleküle vorgesehen. „Ich hoffe, dass sie dort gegen Krebs wirken“, sagt Köhn. Das wäre die erste Stufe auf dem Weg zu neuen Therapien.
Zwei wissenschaftliche Disziplinen, ein Werdegang
Für diesen Schritt wird sich Köhns rund zwölfköpfige Arbeitsgruppe ins Zeug legen. „Eine Hälfte arbeitet eher molekular- und zellbiologisch, die andere eher in der synthetischen Chemie“, sagt die Gruppenleiterin. Auch ihre Karriere vereint beide Disziplinen: Sie begann mit einem Chemiestudium in Kiel, an das sich eine Promotion in Organischer Chemie anschloss. Über das US-amerikanische Harvard kam Köhn ans European Molecular Biology Laboratory EMBL nach Heidelberg: „Dort bin ich zur Biologin geworden.“ Seit 2016 forscht sie in Freiburg. Für das Ende ihrer Laufbahn hat sich Maja Köhn ebenfalls schon Ziele gesetzt: „Ich möchte, dass Phosphatasen dann als Zielproteine für medizinische Wirkstoffe etabliert sind.“
Jürgen Schickinger


